周期表とは?
元素を原子番号順に並べて、性質が周期的に変化する「周期律」の基づいて整理した表です。1869年にロシアの化学者メンデレーエフが、当時知られていた元素を原子量の順(つまり軽い順)に並べて、そこから規則性を発見しました。そのことによって未知の元素も予言し、その後彼の予言通りに発見されていきました。
元素とは … 原子の種類のことです。原子は物質を構成する粒子のことです。
元素の縦の列を「族」、横の行を「周期」といいます。
同じ「族」の元素は、「価電子(かでんし)」の数が同じです。価電子が同じだと似たような化学的な性質を持つ傾向があります。第1族~第18族まであります。つまり縦の元素同志は似たような性質といえます。
価電子とは … 原子の最も外側の電子殻に存在する電子のことです。(希ガス(貴ガス)を除いて、最外殻電子と同じものを指します)
また同じ「周期」の元素は、最外殻の種類が同じです。第1周期~第7周期まであります。具体的には、第1周期はK殻、第2周期はK殻、第3周期はM殻、第4周期はN殻、第5周期はO殻、第6周期はP殻、第7周期はQ殻になります。
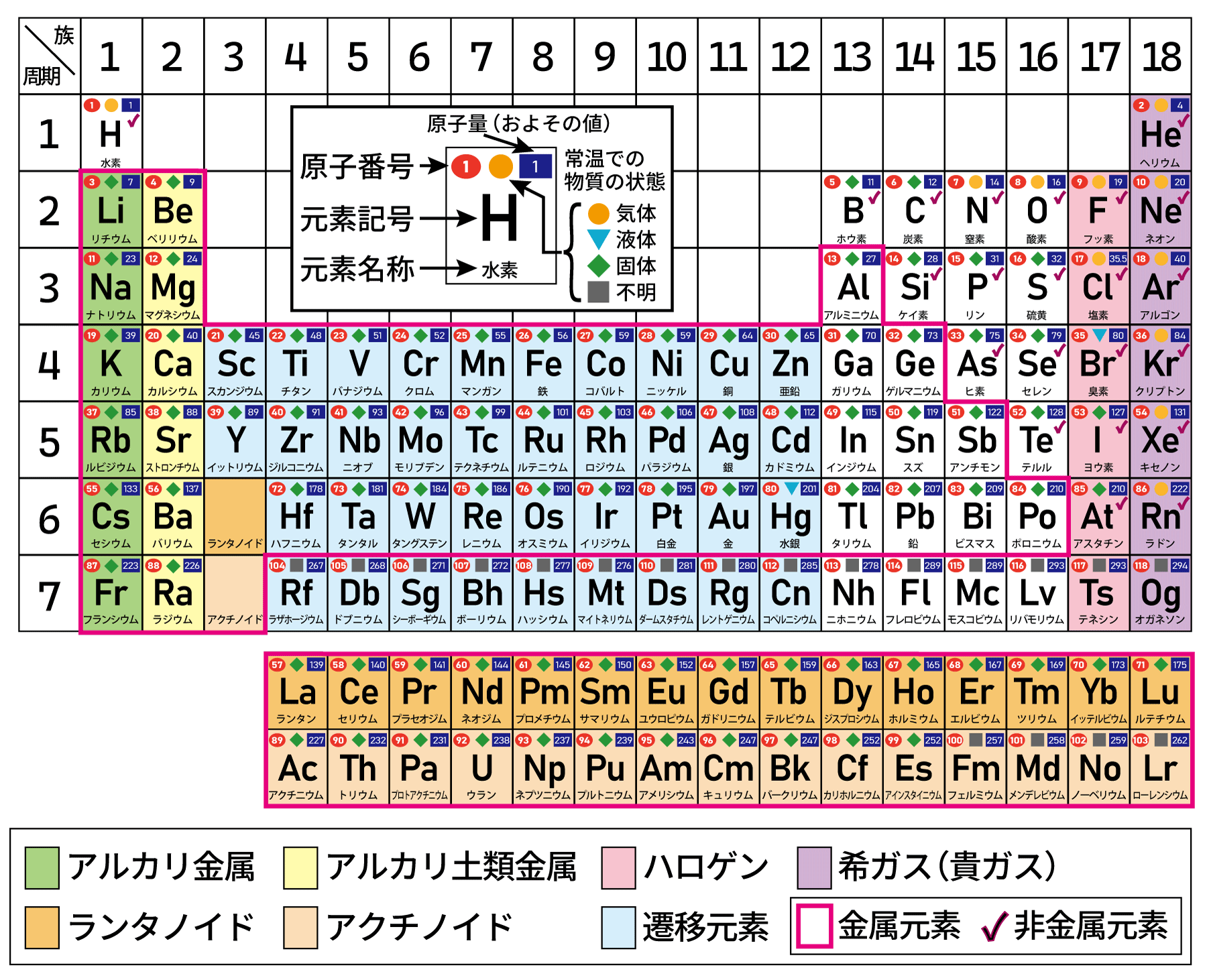
- 第1周期~第6周期の第1~2、13~18族に含まれる元素と第7周期のフランシウム、ラジウムを「典型元素」といいます。
- アルカリ土類金属については、以前はベリリウムとマグネシウムを除いた第2族元素を「アルカリ土類金属」としていましたが、この表では第2族全ての元素を含めています。
- 第12族は、典型元素なのか遷移元素なのかについては議論がありますが、この表では遷移元素として分類しています。
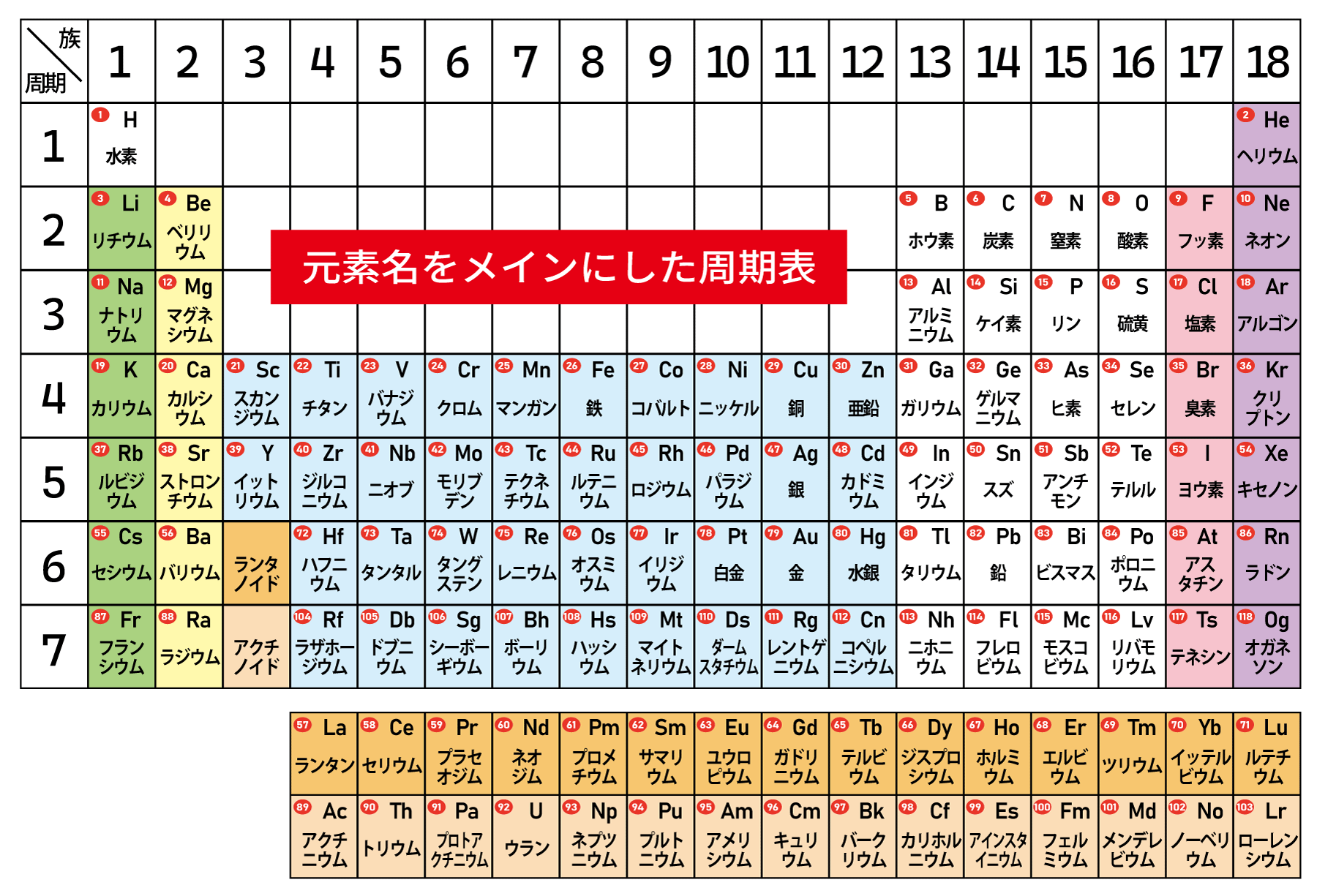
通常の周期表だと元素名が小さくなるので、元素名を拡大した周期表を用意しました。
通常の周期表だと原子量の数字がかなり小さくなるので、原子量を拡大した周期表を用意しました。この表に記されている原子量は概算で、厳密な数値ではありません。(例えば、水素の厳密な原子量は「1.00794」になりますが、このような細かな数値だと扱いずらいのでおよその値としています。)

Cu(銅)の概算原子量は、63.5と表す場合もあります。
原子量とは … 原子1個の質量を表した数値のことですが、原子1個の質量をそのまま表すことは数値が小さすぎて不可能です。そこで、質量数12の炭素同位体(12C)の質量を12と定義し、これを基準にして、他の原子を表します。このように原子量は相対的な数値で単位はありませんが、これらを使って計算をします。
ちなみに同じ元素でも、同位体といって質量が違うものが複数存在することがありますが、その場合は、自然界に存在する割合を考慮に入れて、平均的な数値を算出しています。
周期表の読み方
周期表に関連する用語について解説します。
アルカリ金属とは?
周期表の第1族に属するリチウム [Li]、ナトリウム [Na]、カリウム [K]、ルビジウム [Rb]、セシウム [Cs]、フランシウム [Fr] の6種類の金属元素のことです。金属ですが、密度が小さくて柔らかく、融点が低い金属です。
- これらの元素は1個の価電子を持っているので、電子を1個放出して、1価の陽イオンになりやすい性質があります。(イオン式は、Li+、Na+、K+など)
- イオン化傾向が大きいです。
- 常温で水と激しく反応して水酸化物と水素を生成します。
- 炎色反応を示します。(リチウムは赤色、ナトリウムは黄色、カリウムは紫色、ルビジウムは赤色、セシウムは紫色)
炎色反応とは … 特定の金属などを炎に入れると、特有の炎の色が出る現象のことです。
なぜ「アルカリ」という名称の由来は、水と反応すると強いアルカリ性を示すからです。
アルカリ土類金属とは?
周期表の第2族に属する、ベリリウム [Be]、マグネシウム [Mg]、カルシウム [Ca]、ストロンチウム [Sr]、バリウム [Ba]、ラジウム [Ra] の6種類の金属元素のことです。銀白色の金属で、比較的密度が小さくて柔らかく、融点がやや低い金属です。
ベリリウムとマグネシウムについては性質が異なるため、学術的にはアルカリ土類金属に含めない場合がありますが、IUPAC(国際純正・応用化学連合)という権威のある国際組織の勧告により、まとめて「アルカリ土類金属」とみなします。
- これらの元素は2個の価電子を持っているので、電子を2個放出して、2価の陽イオンになりやすい性質があります。(イオン式は、Be2+、Mg2+、Ca2+など)
- アルカリ金属の次にイオン化傾向が大きいです。
- 水と反応します。(マグネシウムは熱水のみに反応、カルシウム、ストロンチウム、バリウム、ラジウムは水と反応します)
- 硫酸イオン(SO42-)と反応します。(ベリリウムとマグネシウムを除く)
- 水酸化物イオン(OH–)と反応します。(ストロンチウムとバリウムを除く/ラジウムは不明)
- 炎色反応を示します。(ベリリウム、マグネシウム、ラジウムを除く/カルシウムは橙色、ストロンチウムは紅色、バリウムは黄緑色)
なぜ「土類」という名称が付いているのかというと、アルカリ土類金属は自然界に酸化物として存在しており、その様子から熱に強く水にも溶けにくい性質を持っています。このような性質に発見当時の専門家たちが土類と名付けていたことが由来です。
ハロゲンとは?
周期表の第17族に属する、フッ素 [F]、塩素 [Cl]、臭素 [Br]、ヨウ素 [I]、アスタチン [At]、テネシン [Ts] の6種類の元素のことです。全て単体で二原子分子(F2、Cl2、Br2、I2など)として存在しています。
- これらの元素は最外殻に7つの価電子を持っているので、電子を1個受け取って、1価の陰イオンになりやすい性質があります。(F–、Cl–、Br–、I–など)
- フッ素や塩素は水素と激しく反応します。臭素やヨウ素は一定の条件下で反応します。
- 水と反応します。(ヨウ素は水に溶けにくい)
- 金属と結合して、塩(えん)を形成しやすいです。
- 単体で一般的に毒性が強いです。(化学物でも有毒な物質があります)
- 色が付いています。(フッ素は淡黄色の気体、塩素は黄緑色の気体、臭素は赤褐色の固体、ヨウ素は黒紫色の固体、アスタチンとテネシンは不明)
ハロゲンというと、「ハロゲンランプ(白熱電球の一種)」が有名です。電球内部に臭素やヨウ素などのハロゲンガスが入っているので、光度が増し、寿命が長くなる特長があります。
「ハロゲン」はギリシャ語に由来していて、「塩を作るもの」という意味があります。
希ガス(貴ガス)とは?
周期表の第18族に属する、ヘリウム [He]、ネオン [Ne]、アルゴン [Ar]、クリプトン [Kr]、キセノン [Xe]、ラドン [Rn] の6種類の元素のことです。通常は単独の原子で存在しています。
希ガスは、昔は「稀ガス」と呼んでいましたが、現在では「貴ガス」と呼ぶようになっています。この記事では両方を併記しています。
- 最大に特徴は、これらの元素は最外殻電子が非常に安定した配置となっているため、他の元素と反応しにくいです。
- 色・においがありません。
- 融点・沸点が非常に低いです。
- 自然界での存在量は非常に少ないです。
かつて「稀ガス」と呼んでいたのは、微量にしか存在しないことから、そのように呼ばれていました。
遷移元素とは?
- 融点が高く、硬くて密度が大きいという特徴があります。
- 族番号の1の位と価電子の数は一致せずに、価電子の数は1~2個になります。
- 隣同士の元素は似た性質になります。
- 1つの元素が複数の酸化数をとることができます。
- 全て金属元素です。
典型元素とは?
- 同じ族同士では、性質がよく似ています。
- 族番号の1の位と価電子が同じです。
- 金属や非金属の両方が含まれています。


コメント